Vào thập niên 1990, tại phòng thí nghiệm của thuộc Đại học California, Berkeley, Giáo sư (Gs.) James P. Allison và một số đồng nghiệp của mình đã tiến hành các nghiên cứu về CTLA – 4. Không chỉ riêng Gs. Allison mà rất nhiều nhà khoa học khác khi đó đều nhận thấy rằng thấy protein này đóng vai trò như một cái “phanh hãm” trên tế bào T. Trong khi các nhóm nghiên cứu khác ứng dụng điều này trong điều trị các bệnh tự miễn thì Gs. Allison và nhóm của mình lại có ý tưởng táo bạo. Ông cùng các đồng nghiệp đã phát triển một loại kháng thể có thể bám vào CTLA – 4 và bất hoạt chức năng của protein này. Nhờ vậy, cái “phanh” kiềm hãm đã bị phá vỡ và do đó tế bào T đã được giải phóng để chúng có thể tấn công vào tế bào ung thư (12). Năm 1994, thử nghiệm đầu tiên được thực hiện và lặp lại ngay sau kỳ nghỉ Giáng sinh năm đó. Các kết quả thật ngoạn mục. Những con chuột bị ung thư đã khỏi bệnh sau khi được điều trị bằng kháng thể ức chế CTLA – 4. Trong nhiều năm kế tiếp, Gs. Allison đã miệt mài phát triển để đưa các kết quả từ những nghiên cứu này trở thành một chiến lược điều trị ung thư ở người. Cuối cùng, quả ngọt đã đến khi vào năm 2010, một nghiên cứu lâm sàng đã cho thấy hiệu quả điều trị bằng phương thức của Gs. Allison ở những bệnh nhân bị u hắc tố giai đoạn muộn. Ngoài ra, đã có rất nhiều bệnh nhân, dấu hiệu cho thấy sự tồn tại của khối u cũng đã biến mất. Đây là điều chưa từng thấy ở những người bệnh này trước đây.
Hình 8: Chân dung của hai nhà khoa học được trao giải Nobel Y học 2018, Gs. James P. Allison (bên trái) và Gs. Tasuku Honjo (Nguồn: Internet)
Năm 1992, chỉ vài năm trước phát hiện của Allison về CTLA – 4, một nhà khoa học người Nhật Bản là Gs. Tasuku Honjo đã khám phá ra PD – 1. Với quyết tâm làm sáng tỏ vai trò của phân tử này, ông đã nghiên cứu tỉ mỉ chức năng của nó qua nhiều thí nghiệm được thực hiện tại Đại học Kytoto. Các kết quả cho thấy PD – 1, tương tự với CTLA – 4, đóng vai trò là một “phanh hãm” tế bào T, nhưng hoạt động một cơ chế hoàn toàn khác (13). Khi thử nghiệm trên động vật, sự ức chế PD – 1 cho thấy tiềm nằng hứa hẹn trong việc tiêu diệt các tế bào ung thư. Các kết quả không chỉ được chứng minh bởi nhóm của Gs. Honjo mà còn nhiều nhóm nghiên cứu khác. Chính điều này đã mở đường cho việc sử dụng PD – 1 như một chiến lược trong điều trị ung thư. Trong những năm sau đó, những phát triển về mặt lâm sàng vẫn tiếp diễn, và vào năm 2012, một nghiên cứu đã cho thấy hiệu quả rất rõ rệt của phương pháp này trong việc điều trị nhiều loại ung thư khác nhau, đặc biệt là ở những bệnh nhân mà khối u đã di căn, một tình trạng mà trước giờ bị xem là vô phương cứu chữa (6).
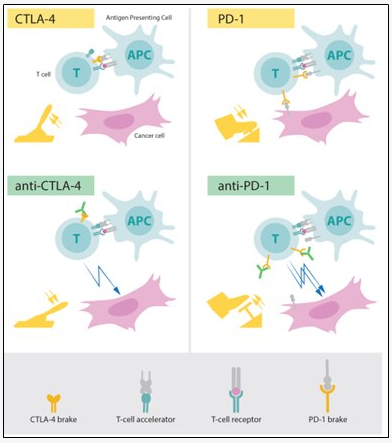
Hình 9: Cơ chế phá vỡ “phanh hãm” và giải phóng tế bào T của kháng thể kháng CTLA – 4 và PD – 1 (6)
Liệu pháp điểm kiểm soát miễn dịch trong điều trị ung thư: hiện thực và triển vọng (6)
Sau những bước đầu về hiệu quả của việc ức chế CTLA – 4 và PD – 1, những phát triển trên lâm sàng đã diễn ra rất nhanh chóng. Giờ đây, chúng ta biết đến chiến lược điều trị này với tên gọi là “Liệu pháp điểm kiểm soát miễn dịch”. Tương tự những liệu pháp khác, tác dụng phụ của việc giải phóng “phanh hãm” của tế bào T là điều không thể tránh khỏi, thậm chí có thể nguy hiểm đến tính mạng của bệnh nhân. Nguyên nhân là đáp ứng miễn dịch quá mức đã dẫn tới các phản ứng tự miễn. Tuy nhiên, điều may mắn là chúng vẫn có thể kiểm soát được. Hàng loạt các nghiên cứu đã và đang được tiến hành nhằm làm sáng tỏ hoàn toàn các cơ chế để cải thiện hiệu quả điều trị và giảm thiểu tối đa tác dụng phụ.
Trong 2 liệu pháp điều trị thì việc sử dụng kháng thể kháng PD – 1 cho thấy hiệu quả cao hơn ở những bệnh nhân thuộc nhiều loại ung thư khác nhau như ung thư phổi, ung thư thận, u lympho và u hắc tố. Thế nhưng, các nghiên cứu lâm sàng gần đây cho sự phối hợp nhắm vào CTLA – 4 và PD – 1, có thể cho hiệu quả điều trị còn tốt hơn nữa, như được chứng minh ở những bệnh nhân bị u hắc tố. Không chỉ dừng lại ở đó, khám phá của Gs. Allison và Gs. Honjo đã tạo ra động lực rất lớn cho những nhà khoa học thế hệ sau tiếp tục cuộc tìm kiếm những protein có khả năng tương tự và là “ứng viên” tiềm năng cho việc thử nghiệm các chiến lược trị liệu miễn dịch mới.
Ở Việt Nam, ý tưởng triển khai liệu pháp miễn dịch đã được GS.BS Tạ Thành Văn, Giám đốc Trung tâm Nghiên cứu Gen-Protein, Phó Hiệu trưởng Trường Đại học Y, Hà Nội và cũng là học trò của Gs. Tasuku Honjo, triển khai từ năm 2013 (14). Sau đó, qua một thời gian khá dài hoàn thiện các thủ tục pháp lý, cơ sở vật chất, cuối năm 2017, Bộ Y tế mới cấp phép cho sử dụng Pembrolizumab trong thực hành lâm sàng điều trị ung thư và hiện đang được sử dụng ở một số bệnh viện. Tuy nhiên, chi phí cho một chu kỳ điều trị lớn, khoảng 60 – 120 triệu đồng và chưa được Bảo hiểm Y tế chi trả. Cho đến nay, các thuốc Atezolizumab, Durvalumab, Tremelimumab đã được cấp phép trong nghiên cứu lâm sàng. Không chỉ dừng lại ở đó, một số bệnh viện lớn ở Việt Nam phối hợp với các công ty dược phẩm và trung tâm nghiên cứu lớn trên thế giới đang tiến hành nghiên cứu các thuốc điều trị miễn dịch trên giai đoạn thử lâm sàng.
Hiện tại Bệnh viện K đã điều trị cho hàng chục bệnh nhân và cần thời gian theo dõi thêm đủ dài để tổng kết, đánh giá hiệu quả. Cũng cần phải nói thêm đây không phải là phương thức chữa khỏi ung thư giai đoạn di căn mà chỉ tiêu diệt phần nào và ức chế, kìm hãm sự phát triển của tế bào ung thư qua đó giúp kéo dài thời gian sống và cải thiện chất lượng cuộc sống cho bệnh nhân ung thư. Hơn nữa trong điều trị ung thư, tuyệt đại đa số các trường hợp để điều trị hiệu quả cần phối hợp đa mô thức và toàn diện, không một phương thức đơn lẻ nào có thể mang lại thành công (15).
Thay lời kết
Từ những nhận thức ban đầu về vai trò của hệ miễn dịch trong ung thư, nhân loại đã tiến những bước đi rất dài, từ các nghiên cứu của Wilhelm Busch và Friedrich Fehleisen cho đến William Coley và giờ là Gs. James P. Allison và Gs. Tasuku Honjo, trong việc ứng dụng sự hiểu biết ấy trở thành một chiến lược điều trị ung thư hiệu quả và đầy tiềm năng. Giờ đây, người ta đang nói đến “Liệu pháp miễn dịch” như một trụ cột thứ 5 (cùng với việc phẫu thuật, hóa trị, xạ trị và điều trị trúng đích) trong cuộc chiến chống lại ung thư của nhân loại (16).
Nguyễn Huỳnh Thanh Tuấn (tổng hợp và biên dịch)
Tài liệu tham khảo
1. Lanh Ngoc N, et al. (2006) Miễn Dịch học (NXB Y học) 2 Ed.
2. Delves PJ, Martin SJ, Burton DR, & Roitt IM (2017) Essential immunology(John Wiley & Sons).
3. Ngoc Van T, et al. (2016) Sinh Lý học Y khoa (NXB Y học) 1 Ed.
4. Abbas AK, Lichtman AH, & Pillai S (2019) Basic Immunology E-Book: Functions and Disorders of the Immune System (Elsevier).
5. Nhan T (Liệu pháp miễn dịch học trong điều trị ung thư. Vietnam Journal of Science.
6. Assembly TN (2018) The Nobel Prize in Physiology or Medicine 2018.
7. Oiseth SJ & Aziz MS (2017) Cancer immunotherapy: a brief review of the history, possibilities, and challenges ahead. Journal of Cancer Metastasis and Treatment¦ Volume 3:251.
8. McCarthy EF (2006) The toxins of William B. Coley and the treatment of bone and soft-tissue sarcomas. The Iowa orthopaedic journal 26:154.
9. Kirkwood JM, et al. (2008) Next generation of immunotherapy for melanoma. Journal of Clinical Oncology26(20):3445-3455.
10. Abbas AK, Lichtman AH, & Pillai S (1994) Cellular and molecular immunology(Elsevier Health Sciences).
11. Ribas A & Wolchok JD (2018) Cancer immunotherapy using checkpoint blockade. Science359(6382):1350-1355.
12. Leach DR, Krummel MF, & Allison JP (1996) Enhancement of antitumor immunity by CTLA-4 blockade. Science 271(5256):1734-1736.
13. Ishida Y, Agata Y, Shibahara K, & Honjo T (1992) Induced expression of PD‐1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. The EMBO journal 11(11):3887-3895.
16. Data G (2017) Immuno-Oncology (IO) looks set to become the fifth pillar of cancer treatment